Drug Master Files (DMFs) Guidelines in Telegu:
Table of Content (toc)
I. Introduction in Telugu:
Drug Master File (DMF) అనేది Food and Drug Administration (FDA) కు సమర్పణ, ఇది ఒకటి లేదా అంతకంటే ఎక్కువ మానవ ఔషధాల తయారీ, ప్రాసెసింగ్, ప్యాకేజింగ్ మరియు నిల్వలో (Storage) ఉపయోగించే సౌకర్యాలు (Facilities), ప్రాసెస్లు లేదా కథనాల గురించి రహస్య (Confidential) వివరణాత్మక సమాచారాన్ని అందించడానికి ఉపయోగపడుతుంది. DMF యొక్క సమర్పణ చట్టం లేదా FDA నియంత్రణ ద్వారా అవసరం లేదు. DMF హోల్డర్ యొక్క అభీష్టానుసారం మాత్రమే సమర్పించబడుతుంది. ఇన్వెస్టిగేషనల్ న్యూ డ్రగ్ అప్లికేషన్ (IND), న్యూ డ్రగ్ అప్లికేషన్ (NDA), సంక్షిప్త న్యూ డ్రగ్ అప్లికేషన్ (ANDA) (Abbreviated New Drug Application (ANDA), మరొక DMF ఎగుమతి అప్లికేషన్ లేదా వీటిలో దేనినైనా సవరణలు మరియు సప్లిమెంట్లకు మద్దతు ఇవ్వడానికి DMF లో ఉన్న సమాచారం ఉపయోగించవచ్చు.
DMF అనేది IND, NDA, ANDA, లేదా ఎగుమతి అనువర్తనానికి ప్రత్యామ్నాయం కాదు. ఇది ఆమోదించబడలేదు లేదా ఆమోదించబడలేదు. IND, NDA, ANDA, లేదా ఎగుమతి అప్లికేషన్ యొక్క సమీక్షకు సంబంధించి మాత్రమే DMF యొక్క సాంకేతిక విషయాలు సమీక్షించబడతాయి.
ఈ మార్గదర్శకం తప్పనిసరి అవసరాలు విధించదు (21 CFR 10.90 (బి)). అయినప్పటికీ, నియంత్రణ అవసరాలను తీర్చడానికి ఆమోదయోగ్యమైన విధానాలపై ఇది మార్గదర్శకత్వాన్ని అందిస్తుంది. వేర్వేరు విధానాలను అనుసరించవచ్చు, కాని ఎఫ్డిఎ తరువాత ఆమోదయోగ్యం కాదని నిర్ణయించే సమర్పణను సిద్ధం చేయడంలో ఖర్చు సమయం మరియు కృషిని నివారించడానికి FDA సమీక్షకులతో (Reviewers) ముందస్తుగా ముఖ్యమైన వైవిధ్యాలను చర్చించమని దరఖాస్తుదారుని ప్రోత్సహిస్తారు.
Drug Master Files లను 21 CFR 314.420 లో అందించారు. ఈ మార్గదర్శకం DMF హోల్డర్లకు DMF ను సిద్ధం చేయడానికి మరియు సమర్పించడానికి ఏజెన్సీకి ఆమోదయోగ్యమైన విధానాలను అందించడానికి ఉద్దేశించబడింది. మార్గదర్శకంలో DMF యొక్క రకాలు, ప్రతి రకంలో అవసరమైన సమాచారం, DMF కి సమర్పణల ఆకృతి, DMF యొక్క సమీక్షను నియంత్రించే పరిపాలనా విధానాలు మరియు DMF హోల్డర్ యొక్క బాధ్యతలను చర్చిస్తుంది.
DMF లు సాధారణంగా DMF యొక్క హోల్డర్ కాకుండా వేరే పార్టీని ఫైల్ యొక్క విషయాలను ఆ పార్టీకి వెల్లడించకుండా విషయాలను సూచించడానికి అనుమతించటానికి సృష్టించబడతాయి. ఒక దరఖాస్తుదారు దాని స్వంత విషయాన్ని ప్రస్తావించినప్పుడు, దరఖాస్తుదారుడు కొత్త DMF ని స్థాపించకుండా దాని స్వంత IND, NDA, లేదా ANDA లో ఉన్న సమాచారాన్ని నేరుగా సూచించాలి.
II. Definitions in Telegu:
ఈ మార్గదర్శకం (Guideline) యొక్క ప్రయోజనాల కోసం, ఈ క్రింది నిర్వచనాలు వర్తిస్తాయి:
II.1. ఏజెన్సీ అంటే Food and Drug Administration (FDA).
II.2. ఏజెంట్ లేదా ప్రతినిధి అంటే హోల్డర్ కోసం పరిచయంగా పనిచేయడానికి DMF హోల్డర్ చేత నియమించబడిన వ్యక్తి.
II.3. దరఖాస్తుదారుడు అంటే ఒక కొత్త ఔషధం లేదా యాంటీబయాటిక్ ఔషధానికి FDA అనుమతి పొందటానికి మరియు ఆమోదించిన దరఖాస్తు కలిగి ఉన్న ఏ ఇతర వ్యక్తి అయినా ఒక దరఖాస్తు లేదా సంక్షిప్త దరఖాస్తు లేదా వారికి సవరణ లేదా అనుబంధాన్ని సమర్పించిన వ్యక్తి (21 CFR 314.3 (బి)).
II.4. ఔషధ ఉత్పత్తి అంటే పూర్తయిన మోతాదు రూపం (Dosage form), ఉదాహరణకు, టాబ్లెట్, క్యాప్సూల్ లేదా ద్రావణం, ఇది ఔషధ పదార్ధాన్ని (Drug substance) కలిగి ఉంటుంది కాని సాధారణంగా ఒకటి లేదా అంతకంటే ఎక్కువ ఇతర పదార్ధాలతో అనుబంధంగా ఉండదు (21 CFR 314.3 (బి)) .
II.5. ఔషధ పదార్ధం (Drug substance) అంటే రోగనిర్ధారణ, నివారణ, ఉపశమనం, చికిత్స లేదా వ్యాధి నివారణలో ఔషధ కార్యకలాపాలు లేదా ఇతర ప్రత్యక్ష ప్రభావాన్ని అందించడానికి లేదా మానవ శరీరం యొక్క నిర్మాణం లేదా ఏదైనా పనితీరును ప్రభావితం చేయడానికి ఉద్దేశించిన క్రియాశీల పదార్ధం (Active Ingredient), కానీ అటువంటి పదార్ధం (Ingredient) యొక్క సంశ్లేషణలో (Synthesis) ఉపయోగించే ఇంటర్మీడియట్లను కలిగి ఉండదు (21 CFR 314.3 (బి)).
II.6. ఎగుమతి అప్లికేషన్ అంటే యునైటెడ్ స్టేట్స్లో మార్కెటింగ్ కోసం ఆమోదించబడని ఔషధాన్ని ఎగుమతి చేయడానికి ఫెడరల్ ఫుడ్, డ్రగ్ మరియు కాస్మెటిక్ యాక్ట్ యొక్క సెక్షన్ 802 కింద సమర్పించిన అప్లికేషన్.
II.7. హోల్డర్ అంటే DMF కలిగి ఉన్న వ్యక్తి.
II.8. లెటర్ ఆఫ్ ఆథరైజేషన్ అంటే మరొక వ్యక్తి సమర్పణకు మద్దతుగా DMF లోని సమాచారాన్ని సూచించడానికి FDA ను అనుమతించే హోల్డర్ లేదా నియమించబడిన ఏజెంట్ లేదా ప్రతినిధి రాసిన స్టేట్మెంట్.
II.9. వ్యక్తిలో వ్యక్తిగత (Individual), భాగస్వామ్యం, కార్పొరేషన్ మరియు అసోసియేషన్ ఉన్నాయి. (ఫెడరల్ ఫుడ్, డ్రగ్ మరియు కాస్మెటిక్ యాక్ట్ యొక్క సెక్షన్ 201 (ఇ).)
II.10. స్పాన్సర్ అంటే క్లినికల్ దర్యాప్తును ప్రారంభించే వ్యక్తి. స్పాన్సర్ ఒక వ్యక్తి లేదా ఔషధ సంస్థ, ప్రభుత్వ సంస్థ, విద్యాసంస్థ, ప్రైవేట్ సంస్థ లేదా ఇతర సంస్థ కావచ్చు (21 CFR 312.3 (బి)).
III. Types of Drug Master Files in Telegu:
ఐదు రకాల DMFలు ఉన్నాయి:
Type I తయారీ సైట్, సౌకర్యాలు (Facilities), ఆపరేటింగ్ విధానాలు మరియు సిబ్బంది.
Type II డ్రగ్ సబ్స్టాన్స్, డ్రగ్ సబ్స్టాన్స్ ఇంటర్మీడియట్ మరియు వాటి తయారీలో ఉపయోగించే మెటీరియల్ లేదా ఔషధ ఉత్పత్తి (Drug Product).
Type III ప్యాకేజింగ్ మెటీరియల్.
Type IV ఎక్సైపియంట్, కలరెంట్, ఫ్లేవర్, ఎసెన్స్, లేదా మెటీరియల్ వాటి తయారీలో వాడతారు.
Type V FDA అంగీకరించిన రిఫరెన్స్ సమాచారం.
ప్రతి DMF లో ఒక రకమైన (Type) సమాచారం మరియు అన్ని సహాయక డేటా మాత్రమే ఉండాలి. ప్రతి రకంలో (Type) కావలసిన సమాచారం యొక్క మరింత వివరణాత్మక వివరణల కోసం మార్గదర్శకం యొక్క విభాగం IV.C చూడండి. DMF లోని సహాయక సమాచారం మరియు డేటాను మరే ఇతర DMF కి అయినా సూచించవచ్చు (పార్ట్ V చూడండి).
IV. SUBMISSIONS TO DRUG MASTER FILES IN TELUGU:
ప్రతి DMF సమర్పణలో ట్రాన్స్మిటల్ లేఖ, సమర్పణ (Submission) గురించి పరిపాలనా (Administrative) సమాచారం మరియు ఈ విభాగంలో వివరించిన విధంగా DMF లో చేర్చవలసిన నిర్దిష్ట సమాచారం ఉండాలి.
DMF తప్పనిసరిగా ఆంగ్ల భాషలో ఉండాలి. సమర్పణలో (Submission) మరొక భాషలో సమాచారం ఉన్నప్పుడల్లా, ఖచ్చితమైన ధృవీకరించబడిన ఆంగ్ల అనువాదం కూడా చేర్చబడాలి.
DMF యొక్క ప్రతి కాపీ యొక్క ప్రతి పేజీకి తేదీ ఉండాలి మరియు వరుసగా లెక్కించబడాలి. ప్రతి సమర్పణతో (Submission) నవీకరించబడిన (Updated) విషయాల పట్టిక చేర్చబడాలి.
IV. A. Transmittal Letters in Telegu:
క్రింది వాటిని చేర్చాలి:
IV. A.1. Original Submissions in Telegu: అసలు సమర్పణలు:
A. సమర్పణ (Submission) యొక్క గుర్తింపు: సెక్షన్ III లో వర్గీకరించబడిన అసలు (Original) DMF రకం మరియు దాని విషయం.
B. ప్రతి స్పాన్సర్, దరఖాస్తుదారు లేదా హోల్డర్ యొక్క పేరు మరియు చిరునామా మరియు అన్ని సంబంధిత పత్ర సంఖ్యలతో సహా మద్దతు ఇవ్వడానికి DMF ఉద్దేశించినట్లు తెలిస్తే, దరఖాస్తుల గుర్తింపు.
C. హోల్డర్ లేదా అధీకృత ప్రతినిధి సంతకం.
D. టైప్ తో వ్రాసిన పేరు మరియు సంతకం యొక్క టైటిల్.
IV. A. 2. Amendments in Telegu: సవరణలు:
A. సమర్పణ (Submission) యొక్క గుర్తింపు: సవరణ (Amendment), DMF సంఖ్య, DMF రకం మరియు సవరణ (Amendment) యొక్క విషయం.
B. సమర్పణ (Submission) యొక్క ఉద్దేశ్యం యొక్క వివరణ, ఉదా. నవీకరణ (Up date), సవరించిన ఫార్ములా లేదా సవరించిన ప్రాసెస్.
C. హోల్డర్ లేదా అధీకృత ప్రతినిధి సంతకం.
D. టైప్ తో వ్రాసిన పేరు మరియు సంతకం యొక్క టైటిల్.
IV. B. Administrative Information in Telegu: పరిపాలనా సమాచారం:
పరిపాలనా సమాచారం క్రింది వాటిని కలిగి ఉండాలి:
IV. B.1. Original Submissions in Telegu: అసలు సమర్పణలు:
A. క్రింది వాటి పేర్లు మరియు చిరునామాలు:
(1) డిఎంఎఫ్ హోల్డర్.
(2) కార్పొరేట్ ప్రధాన కార్యాలయం.
(3) తయారీ / ప్రాసెసింగ్ సౌకర్యం (Manufacturing/processing facility).
(4) FDA కరస్పాండెన్స్ కోసం సంప్రదించండి.
(5) ఏజెంట్ లు, ఏదైనా ఉంటే.
B. సెక్షన్ A లోని ఏదైనా వర్గాలలో జాబితా చేయబడిన ప్రతి వ్యక్తి యొక్క నిర్దిష్ట బాధ్యతలు (Specific Responsibilities).
C. నిబద్ధత యొక్క ప్రకటన (Statement of commitment).
DMF ప్రస్తుతమని మరియు DMF హోల్డర్ అందులో చేసిన స్టేట్మెంట్లకు అనుగుణంగా ఉంటుందని ధృవీకరిస్తూ హోల్డర్ సంతకం చేసిన ప్రకటన.
IV. B2. Amendments in Telegu: సవరణలు:
A. DMF హోల్డర్ పేరు.
B. DMF సంఖ్య.
C. కరస్పాండెన్స్ కోసం పేరు మరియు చిరునామా.
D. ప్రభావిత విభాగం మరియు / లేదా DMF యొక్క పేజీ సంఖ్యలు.
E. IND, NDA, ANDA, DMF లేదా ఎగుమతి అప్లికేషన్ మద్దతు కోసం సవరణ అంశంపై ఆధారపడే ప్రతి వ్యక్తి పేరు మరియు చిరునామా.
F. తెలిస్తే, మద్దతు కోసం సవరణ అంశంపై ఆధారపడే ప్రతి IND, NDA, ANDA, DMF మరియు ఎగుమతి అప్లికేషన్ల సంఖ్య.
G. తెలిస్తే, ప్రభావితమైన IND, NDA, ANDA, DMF మరియు ఎగుమతి అప్లికేషన్ లోని ప్రత్యేక అంశాలు.
IV. C. Drug Master File Contents in Telegu:
IV. C.1. Types of Drug Master Files in Telegu:
IV. C.1. A. Type I: తయారీ సైట్, సౌకర్యాలు, ఆపరేటింగ్ విధానాలు మరియు సిబ్బంది.
యునైటెడ్ స్టేట్స్ వెలుపల ఉన్న వ్యక్తి వారి తయారీ సౌకర్యాల యొక్క సైట్ తనిఖీలను నిర్వహించడానికి FDA కి సహాయం చేయడానికి టైప్ I DMF సిఫార్సు చేయబడింది. తయారీ సైట్, పరికరాల సామర్థ్యాలు మరియు కార్యాచరణ లేఅవుట్ గురించి DMF వివరించాలి.
ఒక వ్యక్తి రిజిస్ట్రేషన్ చేయబడనప్పుడు మరియు మామూలుగా తనిఖీ చేయనప్పుడు వంటి ప్రత్యేక సందర్భాలలో తప్ప, దేశీయ సౌకర్యాలను వివరించడానికి టైప్ I DMF సాధారణంగా అవసరం లేదు.
సైట్ యొక్క వివరణలో ఎకరాల విస్తీర్ణం, వాస్తవ సైట్ చిరునామా మరియు సమీప నగరానికి సంబంధించి దాని స్థానాన్ని చూపించే మ్యాప్ ఉండాలి. ఒక వైమానిక ఛాయాచిత్రం (Aerial Photograph) మరియు సైట్ యొక్క రేఖాచిత్రం (Diagram) సహాయపడవచ్చు.
కార్యాచరణ నమూనాను అర్థం చేసుకోవడానికి ప్రధాన ఉత్పత్తి మరియు ప్రాసెసింగ్ ప్రాంతాల రేఖాచిత్రం (Diagram) సహాయపడుతుంది. ప్రధాన పరికరాలు సామర్థ్యాలు, అప్లికేషన్ మరియు స్థానం పరంగా వివరించాలి. పరికరాలు కొత్తవి లేదా ప్రత్యేకమైనవి కాకపోతే మేక్ మరియు మోడల్ సాధారణంగా అవసరం లేదు.
ఉత్పాదక సైట్ మరియు కార్పొరేట్ ప్రధాన కార్యాలయాలలో కీ తయారీ, నాణ్యత నియంత్రణ (Quality Control) మరియు నాణ్యత హామీ (Quality Assurance) స్థానాలతో హైలైట్ చేయబడిన ప్రధాన కార్పొరేట్ సంస్థాగత అంశాల రేఖాచిత్రం (Diagram) కూడా సహాయపడుతుంది.
IV. C.1.B. Type II: డ్రగ్ సబ్స్టాన్స్, డ్రగ్ సబ్స్టాన్స్ ఇంటర్మీడియట్, మరియు వాటి తయారీలో ఉపయోగించే మెటీరియల్ లేదా ఔషధ ఉత్పత్తి.
ఒక టైప్ II DMF, సాధారణంగా, ఒక ఔషధ ఇంటర్మీడియట్, ఔషధ పదార్ధం (Drug Substance), ఔషధ ఉత్పత్తి లేదా వాటి తయారీలో ఉపయోగించే మెటీరియల్ రకానికి పరిమితం చేయాలి.
IV. C.1.B. (1) డ్రగ్ సబ్స్టాన్స్ ఇంటర్మీడియట్లు, డ్రగ్ సబ్స్టాన్స్ మరియు వాటి తయారీలో ఉపయోగించే మెటీరియల్.
ఔషధ ఇంటర్మీడియట్ లేదా పదార్ధం (Substance) యొక్క తయారీ మరియు నియంత్రణలలో అన్ని ముఖ్యమైన దశలను సంగ్రహించండి. ఔషధ పదార్థాలు మరియు ఇంటర్మీడియట్ల కోసం టైప్ II DMF లో ఏమి చేర్చాలి అనేదానిపై వివరణాత్మక మార్గదర్శకత్వం క్రింది మార్గదర్శకాలలో చూడవచ్చు:
ఔషధ పదార్ధాల (Drug Substance) తయారీకి ఔషధ అప్లికేషన్లల్లో సహాయక డాక్యుమెంటేషన్ సమర్పించడానికి మార్గదర్శకం.
ఒక అప్లికేషన్ యొక్క కెమిస్ట్రీ, తయారీ మరియు నియంత్రణల విభాగం యొక్క ఫార్మాట్ మరియు కంటెంట్ కోసం మార్గదర్శకం.
IV. C.1.B. (2) Drug Product: ఔషధ ఉత్పత్తి:
పూర్తయిన మోతాదు రూపాల (Finished Dosage Forms) తయారీ విధానాలు మరియు నియంత్రణలు సాధారణంగా IND, NDA, ANDA, లేదా ఎగుమతి దరఖాస్తులో సమర్పించాలి. ఈ సమాచారాన్ని IND, NDA, ANDA, లేదా ఎగుమతి దరఖాస్తులో సమర్పించలేకపోతే, అది DMF లో సమర్పించాలి. ఔషధ ఉత్పత్తి కోసం టైప్ II DMF సమర్పించినప్పుడు, దరఖాస్తుదారు / స్పాన్సర్ ఈ క్రింది మార్గదర్శకాలలో అందించిన మార్గదర్శకాన్ని అనుసరించాలి:
ఒక అప్లికేషన్ యొక్క కెమిస్ట్రీ, తయారీ మరియు నియంత్రణల విభాగం యొక్క ఫార్మాట్ మరియు కంటెంట్ కోసం మార్గదర్శకం (Guideline).
ఔషధ ఉత్పత్తుల తయారీ మరియు నియంత్రణల కోసం డాక్యుమెంటేషన్ సమర్పించడానికి మార్గదర్శకం (Guideline).
పద్ధతుల ధ్రువీకరణ (Methods Validation) కోసం సాంపిల్లను మరియు అనలిటికల్ డేటాను సమర్పించడానికి మార్గదర్శకం (Guideline).
IV. C.1.C.Type III: Packaging Material in Telegu:
ప్రతి ప్యాకేజింగ్ సామగ్రిని (Packaging Material) దాని విడుదల కోసం ఉద్దేశించిన ఉపయోగం, భాగాలు (Components), కూర్పు (Composition) మరియు నియంత్రణల (Controls) ద్వారా గుర్తించాలి. ప్యాకేజింగ్ సామగ్రిని (Packaging Material) తయారు చేయడానికి ఉపయోగించే భాగాల (Components) సరఫరాదారులు లేదా ఫాబ్రికేటర్ల పేర్లు మరియు అంగీకార లక్షణాలు (Acceptance Specifications) కూడా ఇవ్వాలి. ప్యాకేజింగ్ మెటీరియల్ యొక్క ఉద్దేశించిన ఉపయోగం కోసం ఆమోదయోగ్యమైన డేటాను "మానవ ఔషధాలు మరియు జీవశాస్త్రాల కొరకు ప్యాకేజింగ్ కొరకు డాక్యుమెంటేషన్ సమర్పించడానికి మార్గదర్శకం" లో చెప్పినట్లుగా సమర్పించాలి.
ఈ పదార్ధాలపై టాక్సికాలజికల్ డేటా ఈ రకమైన DMF క్రింద చేర్చబడుతుంది, లేకపోతే మరొక డాక్యుమెంట్ కి క్రాస్ రిఫరెన్స్ ద్వారా అందుబాటులో ఉండదు.
IV. C.1.D.Type IV ఎక్సైపియంట్, కలరెంట్, ఫ్లేవర్, ఎసెన్స్, లేదా వాటి తయారీలో ఉపయోగించే మెటీరియల్.
ప్రతి సంకలితం (Each Additive) దాని తయారీ పద్ధతి, విడుదల లక్షణాలు మరియు పరీక్షా పద్ధతుల ద్వారా గుర్తించబడాలి మరియు వర్గీకరించబడాలి.
ఈ పదార్ధాలపై టాక్సికాలజికల్ డేటా ఈ రకమైన DMF క్రింద చేర్చబడుతుంది, లేకపోతే మరొక డాక్యుమెంట్ కి క్రాస్ రిఫరెన్స్ ద్వారా అందుబాటులో ఉండదు.
సాధారణంగా రంగు సంకలనాలు (21 CFR భాగాలు 70 నుండి 82 వరకు), ప్రత్యక్ష ఆహార సంకలనాలు (21 CFR భాగాలు 170 నుండి 173 వరకు), పరోక్ష ఆహార సంకలనాలు (21 CFR భాగాలు 174 నుండి 178 వరకు), మరియు ఆహార పదార్థాలు (21 CFR భాగాలు 181 నుండి 186 వరకు) కోసం అధికారిక సంకలనం మరియు FDA నిబంధనలు విడుదల పరీక్షలు, లక్షణాలు మరియు భద్రత కోసం మూలాలుగా ఉపయోగించవచ్చు. టైప్ II DMF కోసం సూచించిన మార్గదర్శకాలు (Guidelines) టైప్ IV DMF ను సిద్ధం చేయడానికి సహాయపడతాయి. DMF మరొక డాక్యుమెంట్ కి క్రాస్ రిఫరెన్స్ ద్వారా అందుబాటులో లేని ఇతర సహాయక సమాచారం మరియు డేటాను కలిగి ఉండాలి.
IV. C.1.E.Type V: FDA Accepted Reference Information in Telegu: FDA అంగీకరించిన సూచన సమాచారం.
ఇతర రకాల DMF లలో ఒకదానిలో చేర్చవలసిన ఇతర సమాచారం, నకిలీ సమాచారం లేదా సమాచారం కోసం టైప్ V DMF యొక్క వాడకాన్ని FDA నిరుత్సాహపరుస్తుంది. IV ద్వారా I రకాలు కవర్ చేయని DMF లో ఏదైనా హోల్డర్ సమాచారం మరియు సహాయక డేటాను సమర్పించాలనుకుంటే, ఒక హోల్డర్ మొదట డ్రగ్ మాస్టర్ ఫైల్ స్టాఫ్కు ఉద్దేశించిన లేఖను సమర్పించాలి (చిరునామా కోసం ఈ విభాగం యొక్క D.5.A. చూడండి). ప్రతిపాదిత సమర్పణపై (Submission) చర్చించడానికి FDA అప్పుడు హోల్డర్ను సంప్రదిస్తుంది.
IV. C.2. General Information and Suggestions in Telegu:
సాధారణ సమాచారం మరియు సూచనలు:
IV. C.2.A. Environmental Assessment in Telegu:
పర్యావరణ అంచనా:
టైప్ II, టైప్ III మరియు టైప్ IV DMF లు దాని సౌకర్యాలు (Facilities) వర్తించే పర్యావరణ చట్టాలకు అనుగుణంగా పనిచేస్తాయని సంస్థ యొక్క నిబద్ధతను కలిగి ఉండాలి. పూర్తి చేసిన పర్యావరణ అంచనా అవసరమైతే 21 CFR పార్ట్ 25 చూడండి.
IV. C.2.B. Stability in Telegu:
"మానవ ఔషధాలు మరియు జీవశాస్త్రం యొక్క స్థిరత్వం (Stability) కోసం డాక్యుమెంటేషన్ సమర్పించడానికి మార్గదర్శకం (Guideline)" లో పేర్కొన్న విధంగా వర్తించేటప్పుడు స్థిరత్వ అధ్యయనం రూపకల్పన (Stability study design), డేటా, వ్యాఖ్యానం (Interpretation) మరియు ఇతర సమాచారం సమర్పించాలి.
IV. D. Format, Assembly, and Delivery in Telegu:
IV. D.1.
అన్ని DMF సమర్పణల (Submission) కోసం అసలు (Original) మరియు నకిలీ (Duplicate) సమర్పించాలి.
ఔషదాల మాస్టర్ ఫైల్ హోల్డర్లు మరియు వారి ఏజెంట్లు / ప్రతినిధులు ఎఫ్డిఎకు సమర్పించిన వాటికి సమానమైన మరియు అదే కాలక్రమంలో నిర్వహించబడే పూర్తి రిఫరెన్స్ కాపీని కలిగి ఉండాలి.
IV. D.2.
అసలు (Original) మరియు నకిలీ (Duplicate) కాపీలు కలిసి ఉండాలి, పూర్తిగా సమావేశమై వ్యక్తిగతంగా జాకెట్ చేయాలి.
DMF యొక్క ప్రతి వాల్యూమ్ సాధారణంగా 2 అంగుళాల మందం ఉండకూడదు. మల్టీవాల్యూమ్ సమర్పణల (Submissions) కోసం, ప్రతి వాల్యూమ్ను నంబర్ చేయండి. ఉదాహరణకు. 3 వాల్యూమ్ సమర్పణ (Submission) కోసం, వాల్యూమ్లు 3 లో 1, 3 లో 2 మరియు 3 లో 3 గా (1 of 3, 2 of 3, and 3 of 3) లెక్కించబడతాయి.
IV. D.3.
యు.ఎస్. ప్రామాణిక కాగితం పరిమాణం (Standard Paper Size) (8-1 / 2 బై 11 అంగుళాలు) ప్రాధాన్యత ఇవ్వబడుతుంది. కాగితం పొడవు 10 అంగుళాల కంటే తక్కువ లేదా 12 అంగుళాల మించకూడదు. ఏదేమైనా నేల ప్రణాళిక (Floor Plan), సంశ్లేషణ రేఖాచిత్రం (Synthesis Diagram), బ్యాచ్ ఫార్ములా లేదా తయారీ సూచనలను ప్రదర్శించడానికి ప్రామాణిక కాగితపు పరిమాణం (Standard Paper Size) కంటే పెద్ద వ్యక్తిగత పేజీలను ఉపయోగించడం అప్పుడప్పుడు అవసరం కావచ్చు. ఆ పేజీలను మడతపెట్టి, మౌంట్ చేయాలి, జాకెట్ను విడదీయకుండా పేజీని సమీక్ష కోసం తెరవడానికి మరియు వాల్యూమ్ నిలిపివేయబడినప్పుడు నష్టం లేకుండా రిఫోల్డ్ చేయడానికి.
IV.D.4.
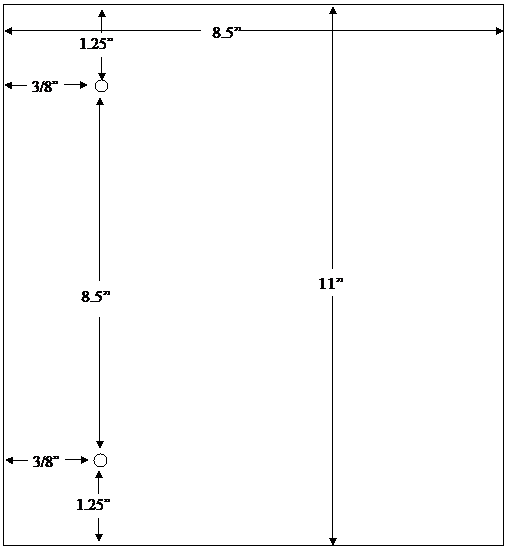
DMF ని దాఖలు చేయడానికి ఏజెన్సీ యొక్క వ్యవస్థ పేజీ యొక్క ఎడమ వైపున అసెంబ్లీని అందిస్తుంది. అంటుకునిఉన్న ప్రదేశంలో (Fastened area) వచనం (Text) అస్పష్టంగా లేదని భరోసా ఇవ్వడానికి ఎడమ మార్జిన్ అంగుళంలో కనీసం మూడు వంతులు ఉండాలి. కుడి మార్జిన్ అంగుళంలో కనీసం సగం ఉండాలి. సమర్పకుడు ప్రతి పేజీలో 8 1/2 అంగుళాల దూరంలో రంధ్రాలను చేయాలి. కింది చిత్రంలో చూపిన పేజీ కొలతలను చూడండి:
IV.D.5. Delivery to FDA
IV.D.5.A.
Drug Master File submissions and correspondence should be addressed as follows:
Drug Master File Staff
Food and Drug Administration
5901-B Ammendale Rd.
Beltsville, MD 20705-1266.
IV.D.5.B. Delivery charges to the above address must be prepaid.
V. AUTHORIZATION TO REFER TO A DRUG MASTER FILE in Telegu:
V. A. Letter of Authorization to FDA in Telegu:
FDA కి అధికార లేఖ:
ఒక అప్లికేషన్ కి మద్దతుగా FDA DMF సమాచారాన్ని సమీక్షించే (Review) ముందు,
DMF హోల్డర్ DMF కు నకిలీలో (Duplicate) DMF ను సూచించడానికి FDA ని అనుమతించే అధికార లేఖను FDA కు సమర్పించాలి. హోల్డర్ క్రాస్ దాని స్వంత DMF ను సూచిస్తే,
ఈ విభాగం యొక్క 3, 5, 6, 7 మరియు 8 అంశాలచే నియమించబడిన సమాచారాన్ని హోల్డర్ అధికార లేఖలో సరఫరా చేయాలి. హోల్డర్ దాని అధికార లేఖతో ట్రాన్స్మిటల్ లేఖను పంపాల్సిన అవసరం లేదు.
అధికారం యొక్క లేఖలో ఈ క్రిందివి ఉండాలి:
(1). The date.
(2). Name of DMF holder.
(3). DMF number.
(4). Name of person(s) authorized to incorporate information in the DMF by reference.
(5). Specific product(s) covered by the DMF.
(6). Submission date(s) of 5, above.
(7). Section numbers and/or page numbers to be referenced.
(8). Statement of commitment that the DMF is current and that the DMF holder will comply with the statements made in it.
(9). Signature of authorizing official.
(10). Typed name and title of official authorizing reference to the DMF.
V. B. Copy to Applicant, Sponsor, or Other Holder in Telegu:
DMF లో ఉన్న నిర్దిష్ట సమాచారాన్ని ప్రస్తావించడం ద్వారా విలీనం చేయడానికి అధికారం ఉన్న బాధిత దరఖాస్తుదారు, స్పాన్సర్ లేదా ఇతర హోల్డర్కు అధికారం లేఖ యొక్క కాపీని కూడా హోల్డర్ పంపాలి. దరఖాస్తుదారుడు, స్పాన్సర్ లేదా DMF ను సూచించే ఇతర హోల్డర్ DMF హోల్డర్ యొక్క అధికార లేఖ యొక్క కాపీని దరఖాస్తులో చేర్చాలి.
VI. PROCESSING AND REVIEWING POLICIES in Telegu:
VI. A. Policies Related to Processing Drug Master Files in Telegu: డ్రగ్ మాస్టర్ ఫైళ్ళను ప్రాసెస్ చేయడానికి సంబంధించిన విధానాలు:
VI. A.1.
DMF లోని సమాచారం మరియు డేటా యొక్క పబ్లిక్ లభ్యత 21 CFR పార్ట్ 20, 21 CFR 314.420 (ఇ) మరియు 21 CFR 314.430 కింద నిర్ణయించబడుతుంది.
VI. A.2.
ఫార్మాట్ మరియు కంటెంట్ కోసం కనీస అవసరాలకు అనుగుణంగా ఉందో లేదో తెలుసుకోవడానికి అసలు DMF సమర్పణ రశీదుపై పరిశీలించబడుతుంది. సమర్పణ పరిపాలనాపరంగా (Administratively) ఆమోదయోగ్యమైతే, FDA దాని రశీదును అంగీకరించి దానికి DMF నంబర్ను కేటాయిస్తుంది.
సమర్పణ (Submission) పరిపాలనాపరంగా (Administratively) అసంపూర్ణంగా లేదా సరిపోకపోతే, అది డ్రగ్ మాస్టర్ ఫైల్ స్టాఫ్ నుండి వివరణ లేఖతో సమర్పకుడికి తిరిగి ఇవ్వబడుతుంది మరియు దానికి DMF సంఖ్య కేటాయించబడదు.
VI. B. Drug Master File Review in Telegu:
ఒక DMF ఆమోదించబడలేదు లేదా నిరాకరించబడలేదు.
IND స్పాన్సర్ ఒక NDA, ANDA లేదా ఎగుమతి అప్లికేషన్ కోసం దరఖాస్తుదారు లేదా మరొక DMF హోల్డర్ DMF లోని విషయాలను సూచనల ద్వారా చేర్చినప్పుడు మాత్రమే ఏజెన్సీ DMF లో సమాచారాన్ని సమీక్షిస్తుంది. గుర్తించినట్లుగా, రిఫరెన్స్ ద్వారా విలీనం తప్పనిసరిగా DMF హోల్డర్ యొక్క అధికార లేఖ యొక్క కాపీతో ఉండాలి.
ఎఫ్డిఎ సమీక్షకులు (Reviewers) DMF లో అందించిన సమాచారంలో లోపాలను కనుగొంటే, లోపాలను వివరించే లేఖ DMF హోల్డర్కు పంపబడుతుంది. అదే సమయంలో లోపం ఉన్న DMF లోని సమాచారంపై ఆధారపడే వ్యక్తికి FDA తెలియజేస్తుంది, సహాయక DMF లో అదనపు సమాచారం అవసరమని. లోపం యొక్క సాధారణ విషయం గుర్తించబడింది, కానీ లోపం యొక్క వివరాలు DMF హోల్డర్కు మాత్రమే తెలుస్తాయి. ఏజెన్సీ లోపం లేఖకు ప్రతిస్పందనగా హోల్డర్ అభ్యర్థించిన సమాచారాన్ని DMF కి సమర్పించినప్పుడు, హోల్డర్ దానితో పాటుగా ట్రాన్స్మిటల్ లేఖ యొక్క కాపీని DMF పై ఆధారపడిన బాధిత వ్యక్తులకు మరియు లోపాలను గుర్తించిన FDA సమీక్షా విభాగానికి పంపాలి. ట్రాన్స్మిటల్ లేఖ లోపాలను పరిష్కరించినట్లు నోటీసు ఇస్తుంది.
VII. HOLDER OBLIGATIONS in Telegu:
నిర్దిష్ట కస్టమర్లకు సంబంధించిన అధికారంలో మార్పుతో సహా ఏదైనా మార్పు లేదా అదనంగా, నకిలీలో (Duplicate) సమర్పించాలి మరియు మునుపటి సమర్పణ (ల) (Submissions) కు తగినంతగా సూచించబడాలి. సూచనలో ప్రభావితమైన తేదీ (లు), వాల్యూమ్ (లు), విభాగం (లు) మరియు / లేదా పేజీ సంఖ్య (లు) ఉండాలి.
VII. A. Notice Required for Changes to a Drug Master File in Telegu: డ్రగ్ మాస్టర్ ఫైల్లో మార్పులకు నోటీసు అవసరం:
DMF లో ఏదైనా సంబంధిత మార్పు గురించి దాని DMF ను ప్రస్తావించిన ప్రతి ప్రభావిత దరఖాస్తుదారు లేదా స్పాన్సర్కు హోల్డర్ తెలియజేయాలి (21 CFR 314. 420 (సి)). ఏదైనా ప్రభావితమైన దరఖాస్తు (ల) ను అవసరమైన విధంగా భర్తీ చేయడానికి లేదా సవరించడానికి స్పాన్సర్ / దరఖాస్తుదారుని అనుమతించడానికి మార్పు చేయడానికి ముందు నోటీసు అందించాలి.
VII. B. Listing of Persons Authorized To Refer to a Drug Master File in Telegu: డ్రగ్ మాస్టర్ ఫైల్ను సూచించడానికి అధికారం ఉన్న వ్యక్తుల జాబితా:
VII. B.1.
[21 CFR 314.420 (d)] ద్వారా DMF లో సమాచారాన్ని పొందుపరచడానికి అధికారం ఉన్న వ్యక్తుల పూర్తి జాబితాను కలిగి ఉండటానికి DMF అవసరం. హోల్డర్ వార్షిక నవీకరణలో (Annual Update) జాబితాను నవీకరించాలి (Update). నవీకరించబడిన జాబితాలో (Updated list) హోల్డర్ పేరు, DMF సంఖ్య మరియు నవీకరణ (Update) తేదీ ఉండాలి. నవీకరణ (Update) తేదీ, వాల్యూమ్ మరియు పేజీ సంఖ్యల ద్వారా ఆ సమాచారం యొక్క స్థానాన్ని పొందుపరచడానికి మరియు ఇవ్వడానికి ప్రతి వ్యక్తికి అధికారం ఉన్న సమాచారాన్ని పేరు (లేదా కోడ్) ద్వారా గుర్తించాలి.
VII. B.2.
మునుపటి సంవత్సరంలో ఎవరి అధికారాన్ని ఉపసంహరించుకున్నారో తగిన శీర్షిక కింద గుర్తించాలి.
VII. B.3.
వార్షికోత్సవ (Anniversary) తేదీన జాబితా మారకపోతే, జాబితా ప్రస్తుతమని DMF హోల్డర్ కూడా ఒక ప్రకటన సమర్పించాలి.
VII. C. Annual Update in Telegu: వార్షిక నవీకరణ:
అసలు సమర్పణ (Original Submission) యొక్క వార్షికోత్సవ తేదీపై హోల్డర్ వార్షిక నివేదికను అందించాలి. ఈ నివేదిక B.1 లో వివరించిన విధంగా అవసరమైన జాబితాను కలిగి ఉండాలి మరియు DMF యొక్క అంశంపై మునుపటి వార్షిక నివేదిక నుండి DMF లో పొందుపరిచిన అన్ని మార్పులు మరియు అదనపు సమాచారాన్ని కూడా గుర్తించాలి. DMF యొక్క విషయం మారకపోతే, DMF హోల్డర్ DMF యొక్క విషయం ప్రస్తుతమని ఒక ప్రకటన ఇవ్వాలి.
DMF లో గతంలో సమర్పించిన మెటీరియల్ మరియు జాబితాలు ప్రస్తుతమున్నాయని ఎఫ్డిఎకు ఏటా అప్డేట్ చేయడంలో లేదా భరోసా ఇవ్వడంలో వైఫల్యం పెండింగ్లో ఉన్న IND, NDA, ANDA, ఎగుమతి అప్లికేషన్, లేదా అటువంటి అనువర్తనానికి ఏదైనా సవరణ లేదా అనుబంధాన్ని ఎఫ్డిఎ రివ్యూలో ఆలస్యం చేస్తుంది, మరియు FDA DMF మూసివేత కోసం విధానాలను ప్రారంభించగలదు (విభాగం IX చూడండి).
VII. D. Appointment of an Agent in Telegu: ఏజెంట్ నియామకం:
ఏజెంట్ను నియమించినప్పుడు, ఏజెంట్ పేరు, చిరునామా మరియు బాధ్యత యొక్క పరిధిని (పరిపాలనా మరియు / లేదా శాస్త్రీయ) ఇచ్చి హోల్డర్ సంతకం చేసిన నియామక లేఖను DMF కి సమర్పించాలి. దేశీయ DMF హోల్డర్లు ఏజెంట్ లేదా ప్రతినిధిని నియమించాల్సిన అవసరం లేదు, అయినప్పటికీ విదేశీ DMF హోల్డర్లు U.S. ఏజెంట్ను నిమగ్నం చేయమని ప్రోత్సహిస్తారు.
VII. E. Transfer of Ownership in Telegu:
DMF యొక్క యాజమాన్యాన్ని (Ownership) మరొక పార్టీకి బదిలీ చేయడానికి, హోల్డర్ FDA మరియు అధికారం ఉన్న వ్యక్తులను లిఖితపూర్వకంగా తెలియజేయాలి. లేఖలో ఈ క్రిందివి ఉండాలి:
(1). బదిలీదారుడి పేరు (Name of transferee).
(2). బదిలీదారుడి చిరునామా (Address of transferee).
(3). బదిలీదారు యొక్క బాధ్యతాయుతమైన అధికారి పేరు
(Name of responsible official of transferee).
(4). బదిలీ యొక్క ప్రభావవంతమైన తేదీ (Effective date of transfer).
(5). బదిలీ చేసే అధికారి సంతకం (Signature of the transferring official).
(6). బదిలీ చేసే అధికారి యొక్క టైప్చేసిన పేరు మరియు టైటిల్
(Typewritten name and title of the transferring official).
క్రొత్త హోల్డర్ బదిలీని అంగీకరించే లేఖను మరియు తగిన చోట DMF లో ఉన్న సమాచారం యొక్క నవీకరణను సమర్పించాలి. క్రొత్త యాజమాన్యానికి సంబంధించిన ఏదైనా మార్పు చేర్చబడాలి (ఉదా. ప్లాంట్ లొకేషన్ మరియు మెథడ్లు).
VIII. MAJOR REORGANIZATION OF A DRUG MASTER FILE in Telegu: డ్రగ్ మాస్టర్ ఫైల్ యొక్క ప్రధాన పునర్వ్యవస్థీకరణ:
DMF యొక్క ప్రధాన పునర్వ్యవస్థీకరణను (Major Reorganization) ప్లాన్ చేసే హోల్డర్ ప్రతిపాదిత మార్పుల యొక్క వివరణాత్మక ప్రణాళికను సమర్పించమని మరియు దాని రివ్యూను డ్రగ్ మాస్టర్ ఫైల్ స్టాఫ్ ద్వారా అభ్యర్థించమని ప్రోత్సహిస్తారు. ప్రధాన పునర్వ్యవస్థీకరణ (Major Reorganization) చేపట్టడానికి ముందు సిబ్బందికి వ్యాఖ్యానించడానికి (To Comment) మరియు సలహాలను అందించడానికి తగిన సమయం ఇవ్వాలి.
IX. CLOSURE OF A DRUG MASTER FILE in Telegu:
డ్రగ్ మాస్టర్ ఫైల్ యొక్క మూసివేత:
DMF ను మూసివేయాలనుకునే హోల్డర్ మూసివేతకు (Closure) కారణాన్ని పేర్కొంటూ డ్రగ్ మాస్టర్ ఫైల్ సిబ్బందికి ఒక అభ్యర్థనను సమర్పించాలి. చిరునామా కోసం విభాగం IV.D.5.A చూడండి.
అభ్యర్థనలో సెక్షన్ VII లో వివరించిన విధంగా హోల్డర్ యొక్క బాధ్యతలు నెరవేరినట్లు ఒక ప్రకటన ఉండాలి.
మునుపటి వార్షిక నివేదిక నుండి DMF లో సమాచారాన్ని పొందుపరచడానికి అధికారం కలిగిన వ్యక్తుల వార్షిక నవీకరణ (Annual Update) మరియు మునుపటి వార్షిక నివేదిక నుండి చేసిన మార్పుల జాబితాను కలిగి లేని DMF ని ఏజెన్సీ మూసివేయవచ్చు. DMF ని మూసివేయాలనే FDA యొక్క ఉద్దేశ్యం గురించి హోల్డర్కు తెలియజేయబడుతుంది.
టెక్స్ట్ లో (Text) సూచించబడిన అనేక మార్గదర్శకాలు (Guidelines) మరియు అందుబాటులో ఉన్న మార్గదర్శకాల (Guidelines) యొక్క ప్రస్తుత జాబితాను ఈ క్రింది వాటి నుండి పొందవచ్చు:
Legislative, Professional, and Consumer Affairs Branch (HFD-365)
Center for Drug Evaluation and Research
Food and Drug Administration
5600 Fishers Lane
Rockville, MD 20857.
కోడ్ ఆఫ్ ఫెడరల్ రెగ్యులేషన్స్ (CFR) యొక్క కాపీలు ఈ క్రింది వాటి నుండి కొనుగోలు చేయవచ్చు:
Superintendent of Documents
U.S. Government Printing Office
Washington, D.C. 20402.
Drug Master Files (DMFs) Guidelines in Telegu:


